bac质粒转化最佳解决方法_bac质粒
1.什么是BAC序列?
2.构建cDNA文库时,比较好的载体是 A.质粒 B.入gt10 C.Ti质粒 D.BAC
3.人工染色体的常用载体
4.为什么构建基因文库
5.E.coli DH10 Bac与DH5α有什么区别
6.piggybac的介绍
7.质粒DNA琼脂糖凝胶电泳图该怎么分析
细菌人工染色体是基于大肠杆菌的F质粒构建的、高通量低拷贝的质粒载体,每个环状DNA分子中携带一个抗生素抗性标记、一个来源于大肠杆菌F因子(致育因子)的严谨型控制的复制子emphasis:role=italicoriSemphasis、一个易于DNA复制的由ATP驱动的解旋酶(RepE)以及三个确保低拷贝质粒精确分配至子代细胞的基因座(emphasis:role=italic、parB和parCemphasis)(link:xlinkhref=i011402图4-15link)。
BAC载体的低拷贝性可以避免嵌合体的产生,减小外源基因的表达产物对宿主细胞的毒副作用。BAC载体空载时大小约7.5kb,在大肠杆菌中以质粒的形式复制,具有一个氯霉素抗性基因(CMsuperscriptksuperscript)。外源基因组DNA片段可以通过酶切、连接克隆到BAC载体多克隆位点上,通过电穿孔的方法将连接产物导入大肠杆菌重组缺陷型菌株。
装载外源DNA后的重组质粒通过氯霉素抗性和emphasis:role=italicLac:Zemphasis基因的α-互补筛选。BAC与YAC和PAC(P1:artificial:chromosomes,P1人工染色体)相似,没有包装限制,可接受的基因组DNA大小也没有固定的限制。大多数BAC文库中克隆的平均大小约120kb,然而个别的BAC重组子中含有的基因组DNA最大可达300kb。
什么是BAC序列?
1、酚抽提法:先用蛋酶K、SDS破碎细胞,消化蛋白,然后用酚和酚-氯萃取,高速离心后取上清,所得DNA大小为100-150kb
2、甲酰胺解聚法:破碎细胞同上,然后用高浓度甲酰胺解聚蛋白质与DNA的结合,再透析获得DNA可得DNA200kb左右。
3、玻璃棒缠绕法:用盐酸胍裂解细胞,将裂解物铺于乙醇上,然后用带钩或U型玻璃棒在界面轻搅,DNA沉淀液绕于玻棒。生成DNA约80kb。
4、异丙醇沉淀法:基本同1法,仅用二倍容积异丙醇替代乙醇,可去除小分子RNA(在异丙醇中可溶状态)
5、表面活性剂快速制备法:用Triton X-100A或NP40表面活性剂破碎细胞,然后用蛋白酶K或酚去除蛋白,乙醇沉淀或透析。
6、加热法快速制备:加热96℃-100℃,五分钟,然后离心后取上清,可用于PCR反应。
7、碱变性快速制备:先用NaOH作用20分钟,再加HCI中和,离心后取上清,含少量DNA。
扩展资料:
DNA提取原则:
1、保证核酸一级结构的完整性;
2、核酸样品中不应存在对酶有抑制作用的有机溶剂和过高浓度的金属离子;
3、其他生物大分子如蛋白质、多糖和脂类分子的污染应降低到最低程度;
4、其他核酸分子,如RNA,也应尽量去除。
百度百科——DNA提取
构建cDNA文库时,比较好的载体是 A.质粒 B.入gt10 C.Ti质粒 D.BAC
中文名称:细菌人工染色体
英文名称:bacterial artificial chromosome;
BAC 定义:利用大肠杆菌F质粒或P1噬菌体为基础构建的用于在大肠杆菌中克隆大片段DNA(100~300 kb)的载体。用于基因组结构的分析。
人工染色体的常用载体
A、终止子位于质粒DNA上,终止密码位于mRNA上,A错误;
B、用农杆菌转化法可将该质粒构建的表达载体导入植物细胞中,将目的基因导入动物细胞的方法是显微法,B错误;
C、用限制酶Ⅰ和DNA连接酶改造后的质粒中仍含有限制酶Ⅱ切割的位点,所以能被限制酶Ⅱ切割,C错误;
D、由于限制酶Ⅱ能编码产物控制合成细胞分裂素的基因,导致细胞分裂素不能正常合成,所以用限制酶Ⅱ处理能防止该质粒构建的表达载体引起植物疯长,D正确.
故选:D.
为什么构建基因文库
(Yeast artificial chromosomes YACs)PYAC4 遗传结构图
YAC 人工染色体载体是利用酿酒酵母(Saccharomyces cerevisiae)的染色体的复制元件构建的载体,其工作环境也是在酿酒酵母中。酿酒酵母的形态为扁圆形和卵形,生长的代时为 90 分钟;含 16 条染色体,其大小为 225-1900kb ,总计有14×106 bp;具真核 mRNA 的加工活性。
1.YAC人工染色体载体的复制元件和标记基因
在 YAC 载体中最常用的是 pYAC4 。由于酵母的染色体是线状的,因此其在工作状态也是线状的。但是,为了方便制备YAC载体, YAC 载体以环状的方式存在,并增加了普通大肠杆菌质粒载体的复制元件和选择标记,以便保存和增殖。
YAC 载体的复制元件是其核心组成成分,其在酵母中复制的必需元件包括复制起点序列即自主复制序列(autonomously replicating sequence, ARS)、用于有丝分裂和减数分裂功能的着丝粒 (centromere , CEN)和两个端粒(TEL)。
YAC 载体为能够满足自主复制、染色体在子代细胞间的分离及保持染色体稳定的需要,必须含有以下元件:
·端粒重复序列(telomeric repeat , TEL):定位于染色体末端一段序列,用于保护线状的 DNA 不被胞内的核酸酶降解,以形成稳定的结构。
·着丝粒(centromere , CEN):有丝分裂过程中纺锤丝的结合位点, 使染色体在分裂过程中能正确分配到子细胞中 。在 YAC 中起到保证一个细胞内只有一个人工染色体的作用。如 pYAC4 使用的是酵母第四条染色体的着丝粒。
·自主复制序列(autonomously replication sequences,ARS) 一段特殊的序列,含有酵母菌中 DNA 进行双向复制所必须的信号。
YAC 载体的选择标记主要用营养缺陷型基因,如色氨酸、亮氨酸和组氨酸合成缺陷型基因 trp 1、 leu 2和 his 3、尿嘧啶合成缺陷型基因 ura3 等,以及赭石突变抑制基因 sup4 。与 YAC 载体配套工作的宿主酵母菌(如AB1380)的胸腺嘧啶合成基因带有一个赭石突变 ade 2-1。带有这个突变的酵母菌在基本培养基上形成红色菌落,当带有赭石突变抑制基因 sup4 的载体存在于细胞中时,可抑制 ade 2-1基因的突变效应,形成正常的白色菌落。利用这一菌落颜色转变的现象,可用于筛选载体中含有外源 DNA 片段插入的重组子。 (Bacterial artificial chromosomes,BACs)
1.F 质粒
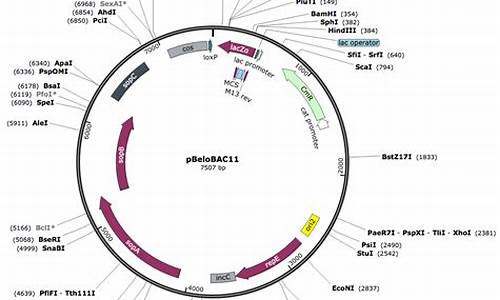
大肠杆菌的 F 因子是一个约 100kb 的质粒。它编码60多种参与复制、分配和接合过程的蛋白质(Willetts and Skurray,1987)。虽然F因子通常以双链闭环DNA(1-2个拷贝/细胞)的形式存在,但它可以在大肠杆菌染色体中至少30个位点处进行随机整合(Low,1987)。携带F因子的细胞,或以游离状态或以整合状态表达三根发样状的F菌毛。F菌毛为供体与受体细胞之间产生性接触所必需。 是基于大肠杆菌的 F 质粒构建的,高通量低拷贝的质粒载体。每个环状 DNA 分子中携带一个抗生素抗性标记,一个来源于大肠杆菌 F 因子(致育因子)的严谨型控制的复制子 oriS ( Shizuya et al. 1992 ),一个易于 DNA 复制的由 ATP 驱动的解旋酶( (RepE) 以及三个确保低拷贝质粒精确分配至子代细胞的基因座 ( parA , parB , 和 parC ) 。 BAC 载体的低拷贝性可以避免嵌合体的产生,减小外源基因的表达产物对宿主细胞的毒副作用。第一代 BAC 载体 (Shizuya et al. 1992) 不含那些能够用于区分携带重组子的抗生素抗性细菌菌落与携带空载体的细菌菌落的标记物。新型的 BAC 载体可以通过α互补的原理筛选含有插入片段的重组子,并设计了用于回收克隆 DNA 的 Not Ⅰ 酶切位点和用于克隆 DNA 测序的 Sp6 启动子、 T7 启动子 (Kim et al. 1996; Asakawa et al. 19) 。 Not Ⅰ 识别序列,位点十分稀少。重组子通过 Not Ⅰ 消化后,可以得到完整的插入片段。 Sp6 、 T7 是来源于噬菌体的启动子,用于插入片段末端测序。图 3-28 是 pBeloBAC11 遗传结构图。
BAC 与 YAC 和 PAC(P1 artificial chromosomes , P1 人工染色体 ) 相似,没有包装限制,因此可接受的基因组 DNA 大小也没有固定的限制。大多数 BAC 文库中克隆的平均大小约 120kb ,然而个别的 BAC 重组子中含有的基因组 DNA 最大可达 300kb 。
F 质粒能够编码形成性菌的蛋白,通过大肠杆菌的结合转移可以进行遗传物质的转移。但是基因操作的时候一般不用这种自发的转化方式。 BAC 载体空载时大小约 7.5kb ,在大肠杆菌中以质粒的形式复制,具有一个氯霉素抗性基因。外源基因组 DNA 片段可以通过酶切、连接克隆到 BAC 载体多克隆位点上,通过电穿孔的方法将连接产物导入大肠杆菌重组缺陷型菌株。装载外源 DNA 后的重组质粒通过氯霉素抗性和 Lac Z 基因的 α – 互补筛选。
三、P1 噬菌体载体和 P1 人工染色体载体 (Bacteriophage P1 vectors)
是 Sternberg 基于 P1 噬菌体构建的,与黏粒载体工作原理比较相似的一种高通量载体。它含有很多 P1 噬菌体来源的顺式作用元件,能容纳 70~100kb 大小的基因组DNA片段(Sternberg 1990, 1992, 1994) 。在这种系统中,含有基因组和载体序列的线状重组分子在体外被组装到 P1 噬菌体颗粒中,后者总容量可达 115kb (包括载体和插入片段)。将重组 DNA 注射到表达 Cre 重组酶的大肠杆菌中,线状 DNA 分子通过重组于载体的两个 loxP 位点之间而发生环化。另外,载体还携带一个通用的选择标记 kan r ,一个区分携带外源 DNA 克隆的阳性标记 sacB 以及一个能够使每个细胞都含有约一个拷贝环状重组质粒的 P1 质粒复制子。另一个 P1 复制子( P1 裂解性复制子)在可诱导的 lac 启动子(IPTG 诱导)控制下,用于 DNA 分离前质粒的扩增。图 3-29 是 P1 噬菌体载体 pAd10sacBII 的遗传结构图。2.P1 人工染色体(P1 artificial chromosomes)
结合了 P1 载体和 BAC 载体的最佳特性,包括阳性选择标记 sacB 及噬菌体 P1 的质粒复制子和裂解性复制子。然而除了将连接产物包装进入噬菌体颗粒以及在 cre-loxP 位点使用位点特异性重组产生质粒分子以外,在载体连接过程中产生的环状重组 PAC 也可能用电穿孔的方法导入大肠杆菌中,并且以单拷贝质粒状态维持 (Ioannou et al. 1994) 。基于 PAC 的人类基因组文库插入片段的大小在 60kb~150kb 之间。
E.coli DH10 Bac与DH5α有什么区别
(1). 质粒文库 质粒是最早用于基因克隆的载体。现已有各种适用于不同工作的如克隆、表达、测序等专用商品质粒。但在构建基因文库上,由于质粒相对较小并只能容纳比自身更小的片段,因此它不能用于构建核基因组文库,通常只用来构建短序列的克隆文库。例如叶绿体DNA分子较小,可以用质粒构建叶绿体DNA文库。质粒载体可用于生物cDNA文库构建。但只适合于高丰度的mRNA。(2). 噬菌体文库 目前用于基因克隆的噬菌体载体及其衍生载体很多,如单链的M13噬菌体载体、λ噬菌体载体、P1噬菌体载体、噬菌粒(phagemid或phasmid)等。其中使用最多的是入噬菌体。 λ-DNA为双链结构,长49kb。线性分子两端各有一条12个核苷酸的黏性末端称cos位点。分子中有约15kb可去掉的非必要基因区,又称“填充区”, “填充区”两侧的序列含有其增殖所必需的全部基因,称为左、右臂。“填充区”可被外源DNA取代,构成重组体,这是它成为克隆载体的结构基础。由于噬菌体头部包装容量的限制,重组λ-DNA分子大小只能在39—52kb之间。(3). 黏粒文库 黏粒(cosmid)也称柯斯质粒,是人工构建的由λ噬菌体的COS序列、质粒的复制子序列及抗生素抗性基因序列组合而成的一类特殊的质粒载体。COS序列是DNA包装进噬菌体颗粒所必须的。复制子通常是使用ColEl或pMBl的复制起始位点。黏粒具有λ噬菌体的某些性质,在克隆了大小合适的外源DNA片段并且在体外被包装成噬菌体颗粒后,能高效转导对入噬菌体敏感的大肠杆菌宿主细胞。在宿主细胞内按λ噬菌体方式环化,但不能通过溶菌周期,无法形成子代噬菌体颗粒(因分子中不具入噬菌体全部必要基因)。它也具有质粒载体的主要性质,在宿主细胞内可以像其他质粒一样复制,并与松弛型质粒相同,适量的氯霉素可促进扩增。因具抗生素基因,可以通过抗生素抗性筛选重组子。黏粒载体在构建时也加上了设在插入失活基因内的多克隆位点。黏粒载体的分子较小(2.8—24kb),但克隆容量很高,对外源DNA长度的要求是30~45 kb,上限几乎是入噬菌体载体容量(23 kb)的2倍,所以黏粒载体在核基因组文库构建上具有相当的优势,可克隆包括3,和5’调控区在内的完整的植物基因。(4).人工染色体文库 人工染色体载体是利用真核生物染色体或原核生物基因组的功能元件构建的能克隆大于50kbDNA片段的人工载体。其中有的载体既可用于克隆,又能直接转化,是进行基因功能研究的良好载体。近年来陆续发展起来的人工染色体文库有YAC库、BAC库、BIBAC库、PAC库及TAC库。
piggybac的介绍
DH5α是最最常用的质粒克隆的菌株。
DH5α在使用pUC系列质粒载体转化时,可与载体编码的β-半乳糖苷酶氨基端实现α-互补。可用于蓝白斑筛选鉴别重组菌株。
菌株中很多重组酶、修饰酶等缺失,防止质粒的重组、修饰,能够保持携带质粒的稳定性。
本底蛋白表达较低,便于提取高纯度质粒。
一般常用于质粒的构建、扩增,较少用于蛋白表达。
DH10 Bac是一种比较特殊的感受态细胞,在昆虫-杆状真核表达系统专门用于生产重组杆状。细胞内含有Bacmid和质粒。
连有目的基因的pfastBac系列载体转入细胞后,会在helper的帮助下与Bacmid发生重组,产生重组杆状,提取出来后可直接用于昆虫细胞的转染。生产目的蛋白。
质粒DNA琼脂糖凝胶电泳图该怎么分析
PiggyBac(PB)转座子来源于 鳞翅目昆虫,最初是在研究杆状(Baculovirus)侵袭粉纹夜蛾细胞系TN-368时首次发现并分离到的1。在分类上属于真核生物的第二类转座子,是一个自主因子,长2 476 bp,有短的末端反向重复序列(ITR)和一个开放编码框(ORF),ITR长13bp,ORF长2.1kb。PB转座子主要取“cut-paste”机制发生转座。PB系统转座效率高,宿主范围广,广泛应用于昆虫等低等生物的基因转移及突变筛选。利用PB转座子构成的载体-质粒系统已成功地获得了转基因地中海果蝇、黑腹果蝇和家蚕。PB转座子具有广泛的转座活性,较少地依赖于宿主因子即可实现高效转座。近年来,研究发现PB系统在哺乳动物及其细胞中也具有高效的转座活性,已在动物基因组功能研究、基因转移及诱导多能干细胞等领域得到了广泛应用。
这个问题太宽泛了吧?到底是想问什么?最左边那一道我默认是核酸marker,那么右边四条道都是你的目标样品,首先可以看大小,你的四个样品的目标带都一致,且分子量肯定是比 marker最上面那条还大,然后看纯度,你的四个样品都比较干净,没有杂带,没有降解!虽然你没有写marker的货号 不知道每条带的分子量,但从你0.8%的浓度看,你的样品应该是BAC之类的吧?做的基因重组?或者本来就是提的基因组DNA?
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。












